Đề kiểm tra 15 phút
Phòng Giáo dục và Đào tạo …..
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 1)
Câu 1: Nêu các thí dụ chứng minh rằng oxi là một đơn chất phi kim rất hoạt động (đặc biệt ở nhiệt độ cao).
Câu 2: Khi cho 0,36N phân tử khí oxi phản ứng vừa hết với a gam Fe, thu được Fe2O3. Giá trị của a đem dung là bao nhiêu? Lấy N = 6.1023.
Đáp án và hướng dẫn giải
Câu 1: Ví dụ: Oxi tác dụng với hầu hết các chất ở nhiệt độ cao:
4P + 5O2 −to→ 2P2O5; C + O2 −to→ CO2
3Fe + 2O2 −to→ Fe3O4; S + O2 −to→ SO2
Câu 2: Số nguyên tử oxi = nO2 x 6.1023 → nO2= 0,36N/N = 0,36 (mol)
Phản ứng: 4Fe + 3O2 −to→ 2Fe2O3 (1)
(mol) 0,48 ← 0,36
Từ (1) → nFe = 0,48 (mol) → mFe = 0,48 x 56 = 26,88 (gam).
Phòng Giáo dục và Đào tạo …..
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 2)
Câu 1: Đốt cáy hoàn toàn 3,36 lít CH4 (đktc). Xác định thể tích không khí cần dùng cho phản ứng trên (đktc).
Câu 2: Để đốt cháy hoàn toàn a gam cacbon thì cần vừa đủ 1,5.1024 phân tử khí oxi. Hãy tính giá trị của a.
Đáp án và hướng dẫn giải
Câu 1: Ta có: nCH4= 3,36/22,4 = 0,15 (mol)
Phản ứng: CH4 + 2O2 −to→ CO2 + 2H2O (1)
(mol) 0,15 → 0,3
Từ (1) → nO2= 0,3 (mol) → VO2= 0,3 x 22,4 = 6,72 (lít)
Vì VKK = 5VO2 → VKK = 5 x 6,72 = 33,6 (lít)
Câu 2: Ta có: nO2= (1,5.1024)/(6.1023) = 2,5 (mol)
Theo phản ứng: nC = nO2 = 2,5 (mol) → mC = a = 2,5 x 12 = 30 (gam)
Phòng Giáo dục và Đào tạo …..
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 3)
Câu 1: Phản ứng hóa hợp là gì? Nêu ví dụ minh họa.
Câu 2:
a) Hãy dự đoán hiện tượng xảy ra và giải thích hiện tượng đó khi cho một cây nến đang cháy vào một lọ thủy tinh rồi đậy nút kín.
b) Vì sao khi tắt đèn cồn người ta đậy nắp đèn lại?
Câu 3: Khi đốt 0,3 mol cacbon trong bình chứa 0,2 mol khí oxi thì khối lượng khí cacbonic thu được là bao nhiêu?
Đáp án và hướng dẫn giải
Câu 1: Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Ví dụ: 2Na + Cl2 → 2NaCl ; 3Fe + 2O2 −to→ Fe3O4
Câu 2:
Khi cho một cây nến đang cháy vào một lọ thủy tinh rồi đậy nút kín, ta thấy ngọn lửa cây nến sẽ yếu dần rồi tắt, vì khi cây nến cháy, lượng oxi trong lọ thủy tinh sẽ giảm dần rồi hết, lúc đó nến sẽ tắt.
Khi tắt đèn cồn, người ta đậy nắp đèn lại để ngăn không cho cồn và không khí tiếp xúc (trong không khí có oxi).
Câu 3: Phản ứng: C + O2 −to→ CO2 (1)
(mol) 0,2 ← 0,2 → 0,2
Vì nC : nO2= 1 : 1 và nC = 0,3 mol > nO2= 0,2 mol
→ sau phản ứng (1) thì cacbon dư: nC dư = 0,3 – 0,2 = 0,1 (mol)
Từ (1) → nCO2= 0,2 (mol) → mCO2= 0,2 x 44 = 8,8 (gam)
Phòng Giáo dục và Đào tạo …..
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 4)
Câu 1: Hãy giải thích vì sao:
a) Khi càng lên cao thì tỉ lệ thể tích khí oxi trong không khí càng giảm?
b) Phản ứng cháy của các chất trong bình chứa oxi lại mãnh liệt hơn trong không khí?
c) Vì sao nhiều bệnh nhân bị khó thở và người thợ lặn làm việc lâu dưới nước … đều phải thở bằng khí oxi nén trong bình đặc biệt?
Câu 2: Cho 2,16 gam một kim loại R hóa trị (III) tác dụng hết với lượng khí oxi dư, thu được 4,08 gam một oxit có dạng R2O3. Xác định tên và kí hiệu hóa học của kim loại R.
Đáp án và hướng dẫn giải
Câu 1:
Khi càng lên cao thì tỉ lệ thể tích khí oxi trong không khí càng giảm vì khí oxi nặng hơn không khí.
Phản ứng cháy của các chất trong bình chứa oxi lại mãnh liệt hơn trong không khí, vì ở trong bình chứa oxi, bề mặt tiếp xúc của các chất cháy với oxi lớn hơn nhiều lần trong không khí.
Bệnh nhân bị khó thở và những người thợ lặn làm việc lâu dưới nước … đều phải thở bằng khí oxi nén trong bình đặc biệt, vì oxi cần cho sự hô hấp để oxi hóa chất dinh dưỡng trong cơ thể con người sinh ra năng lượng để duy trì sự sống.
Câu 2: Phản ứng:
4R + 3O2 −to→ 2R2O3
(gam) 4R 2(2R+48)
(gam) 2,16 4,08
4R/2,16= (2(2R+48))/4,08
1,92R = 51,84 ↔ R = 27 : Nhôm (Al).
Phòng Giáo dục và Đào tạo …..
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 5)
Câu 1: Cho các oxit có công thức hóa học như sau:
a) SO3; b) N2O5; c) CO2;
d) Fe2O3; e) CuO; g) CaO.
Những chất nào thuộc loại oxit bazơ, những chất nào thuộc loại oxit axit?
Câu 2: Cho các công thức oxit sau: Fe2O3, Al2O3, P2O5, NO2, ZnO, CO2, N2O, Cu2O, FeO. Hãy đọc tên các công thức oxit trên.
Đáp án và hướng dẫn giải
Câu 1: Oxit bazơ: Fe2O3, CuO, CaO.
Oxit axit: SO3, N2O5, CO2.
Câu 2:
Fe2O3: sắt (III) oxit Al2O3: nhôm oxit
P2O5: điphotpho pentaoxit NO2: nitơ đioxit
ZnO: kẽm oxit CO2: cacbon đioxit
N2O: đinitơ oxit Cu2O: đồng (I) oxit
FeO: sắt (II) oxit
Đề kiểm tra 1 tiết
Phòng Giáo dục và Đào tạo …..
Đề kiểm tra 45 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 1)
Câu 1: Đốt cháy 7,44 gam photpho trong bình chứa 6,16 lít khí O2 (đktc) tạo ra ddiphotpho pentaoxit. Tính khối lượng chất còn dư sau phản ứng.
Câu 2: Cho 4 gam hỗn hợp X gồm C và S, trong đó S chiếm 40% khối lượng. Đốt cháy hoàn toàn hỗn hợp X. tính thể tích khí oxi (đktc) cần dùng.
Câu 3: Khi cho 0,36N phân tử khí oxi phản ứng vừa hết với a gam Fe, thu được Fe2O3. Giá trị của a đem dùng là bao nhiêu? Lấy N = 6.1023.
Đáp án và hướng dẫn giải
Câu 1: Ta có: nP = 7,44/31 = 0,24 (mol); n_(O_2 )= 6,16/22,4 = 0,275 (mol)
Phản ứng: 4P + 5O2 −to→ 2P2O5 (1)
(mol) 0,22 ← 0,275
Lập tỉ số:
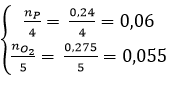
→ sau phản ứng (1) thì P dư.
Vậy khối lượng P dư là: (0,24 – 0,22) x 31 = 0,62 (gam).
Câu 2: Vì S chiếm 40% → mS = 40 x 4/100 x 16 = 1,6 (gam)
→ nS = 1,6/32 = 0,05 (mol).
Và mC = 4 – 1,6 = 2,4 (gam) → nC = 2,4/12 = 0,2 (mol).
Phản ứng: S + O2 −to→ SO2 (1)
C + O2 −to→ CO2 (2)
Từ (1), (2) → ∑nO2 = 0,2 + 0,05 = 0,25 (mol)
→ VO2= 0,25 x 22,4 = 5,6 (lít) = 5600ml.
Câu 3: Số phân tử oxi = nO2 x 6.1023 → nO2= 0,36N/N = 0,36 (mol).
Phản ứng: 4Fe + 3O2 −to→ 2Fe2O3 (1)
(mol) 0,48 ← 0,36
Từ (1) → nFe = 0,48 (mol) → mFe = 0,48 x 56 = 26,88 (gam).
Phòng Giáo dục và Đào tạo …..
Đề kiểm tra 45 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 2)
Câu 1: Tính thể tích khí oxi cần thiết để đốt cháy hoàn toàn khí metan CH4 có trong 1m3 khí chứa 2% tạp chất không cháy. Các thể tích đó được đo ở đktc.
Câu 2: Cho các phản ứng sau:
2Cu + O2 −to→ 2CuO
CuO + H2 −to→ Cu + H2O
CaCO3 −to→ CaO + CO2↑
4FeO + O2 −to→ 2Fe2O3
Ba(OH)2+ FeCl2 → BaCl2 + Fe(OH)2↓
BaO + H2O → Ba(OH)2
2KClO3 −to→ 2KCl + 3O2↑
BaCO3 −to→ BaO + CO2↑
Fe2O3 + 2Al −to→ Al2O3 + 2Fe
2KMnO4 −to→ K2MnO4 + MnO2 + O2↑
2Fe(OH)3 −to→ Fe2O3 + 3H2O
CaCO3 + 2HCl →CaCl2 + CO2↑ + H2O
Hãy cho biết phản ứng nào là phản ứng háo hợp? Phản ứng nào là phản ứng phân huỷ?
Câu 3:
Lập công thức hoá học một loại oxit của photpho, biết rằng hoá trị của photpho là V.
Lập công thức hoá học của crom(III) oxit.
Đáp án và hướng dẫn giải
Câu 1: Thể tích khí metan CH4 nguyên chất:
(1000 x 98)/100 = 980 (lít) ; (1m3 = 1000 lít)
Ta có: nCH4 = VCH4/22,4= 980/22,4 = 43,75 (mol)
Phương trình hoá học : CH4 + 2O2 −to→ CO2 + 2H2O
Theo phương trình hoá học: 1 mol CH4 tham gia phản ứng cần 2 mol O2
43,75 mol CH4 tham gia phản ứng cần 87,5 mol O2
Vậy: VO2 = 22,4 x nO2 )= 22,4 x 87,5 = 1960 (lít).
Câu 2: Phản ứng hoá hợp là: 1, 4 và 6.
Phản ứng phân huỷ là: 3, 7, 8, 10, 11.
Câu 3 :
Gọi công thức hoá học : PxOy.
Quy tắc háo trị : x.V = y.II → x=2, y=5
Vậy công thức hoá học của photpho(V) oxit là : P2O5.
Gọi công thức hoá học : CrxOy.
Quy tắc hoá trị : x.III = y.II → x=2, y=3
Vậy công thức hoá học của crom(III) oxit là : Cr2O3.
Phòng Giáo dục và Đào tạo …..
Đề kiểm tra 45 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 3)
Câu 1: Đốt cháy 5,6 gam hỗn hợp cacbon và lưu huỳnh cần 6,72 lít khí oxi (đktc). Tính khối lượng của mỗi chất trong hỗn hợp ban đầu.
Câu 2 : Cho 2,16 gam một kim loại R hoá trị III tác dụng hết với lượng khí oxi dư, thu được 4,08 gam một oxit có dạng R2O3. Xác định tên và kí hiệu hoá học của kim loại R.
Câu 3: Một loại quặng sắt manhetit chứa 90% Fe3O4. Tính khối lượng của Fe có trong 1 tấn quặng trên.
Câu 4 : Cho 5,68 gam P2O5 vào cốc chứa 2,7 gam H2O thu được dung dịch axit photphoric (H3PO4). Tính khối lượng axit tạo thành.
Đáp án và hướng dẫn giải
Câu 1 : Gọi a là số mol của cacbon và b là số mol của lưu huỳnh.
Ta có : nO2= 6,72/22,4 = 0,3 (mol)
Phản ứng : C + O2 →(−to→ ) CO2 (1)
(mol) a → a
S + O2 −to→ SO2 (2)
(mol) b → b
Theo đề bài, ta có hệ phương trình: {12a + 32b = 5,6 và a + b=0,3 ⇔ {(a = 0,2 mol và b = 0,1 mol)
Vậy mC = 0,2 x 12 = 2,4 (gam); mS = 0,1 x 32 = 3,2 (gam).
Câu 2: Phản ứng: 4R + 3O2 →(−to→ ) 2R2O3
(gam) 4R 2(2R+48)
(gam) 2,16 4,08
4R/2,16= (2(2R+48))/4,08 → 4,08R = 2,16R + 51,84
1,92R = 51,84 → R = 27: Nhôm (Al).
Câu 3: Khối lượng Fe3O4 có trong 1 tấn quặng là: 1 x 90/100 = 0,9 (tấn).
Trong 232 gam Fe3O4 có chứa 168 gam Fe.
0,9 tấn Fe3O4 có chứa a gam Fe.
A = (0,9 x 168)/232= 0,6517 (tấn).
Câu 4: Ta có: nP2 O5 )= 5,68/142 = 0,04 (mol) và nH2 O)= 2,7/18 = 0,15 (mol)
P2O5 + 3H2O → 2H3PO4 (1)
(mol) 0,04 → 0,08
Lập tỉ số : nP2 O5/1= 0,04/1 < nH2 O/3= 0,15/3
Sau phản ứng (1) thì P2O5 hết.
Từ (1) → nH3 PO4= 0,08 (mol) → mH3 PO4= 0,08 x 98 = 7,84 (gam).
Phòng Giáo dục và Đào tạo …..
Đề kiểm tra 45 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 4)
Câu 1: Khi oxi hoá 2 gam một kim loại M thu được 2,54 gam oxit, trong đó M có hoá trị IV. Xác định kim loại M.
Câu 2: Cho phản ứng:
Fe(NO3)3 −to→ Fe2O3 + NO2↑ + O2↑
Cần lấy bao nhiêu gam Fe(NO3)3 để điều chế lượng oxi tác dụng vừa đủ với bari tạo thành 36,72 gam oxit?
Câu 3: Đốt cháy hoàn toàn một hỗn hợp khí Z gồm CO và H2 cần dùng 4,48 lít khí O2 (đktc). Thể tích khí sinh ra chứa 3,36 lít CO2. Hãy tính thành phần phần trăm theo thể tích mỗi khí trong hỗn hợp ban đầu.
Đáp án và hướng dẫn giải
Câu 1: Phản ứng:
M + O2 −to→ MO2
(gam) M (M+32)
(gam) 2 2,54
M/2= (M+32)/2,54 → 2,54M = 2M + 64 → M = 118,5 (Sn).
Câu 2: Ta có: nBaO = 36,72/153 = 0,24 (mol)
4Fe(NO3)3 −to→ 2Fe2O3 + 12NO2 + 3O2↑ (1)
(mol) 0,16 ← 0,12
O2 + 2Ba −to→ 2BaO (2)
(mol) 0,12 ← 0,24
Từ (1) và (2):
nFe(NO3 )3 = 0,16 (mol) → mFe(NO3 )3 = 0,16 x 242 = 38,72 (gam).
Câu 3: Ta có: nO2= 4,48/22,4= 0,2 (mol) và nCO2= 3,36/22,4= 0,15 (mol)
Phản ứng :
2CO + O2 →(−to→ ) 2CO2 (1)
(mol) 0,15 0,075 ← 0,15
2H2 + O2 →(−to→ ) 2H2O (2)
(mol) 0,25 → 0,125 0,25
Từ (1) → nO2 phản ứng = 0,075 (mol)
→ nO2/(2)= 0,2 – 0,075 = 0,125 (mol)
Vì là chất khí nên %V = %n
Vậy %VCO = %nCO = 0,15/(0,15+0,25) x 100% = 37,5%
%VH2 =%nH2 = 100% – 37,5% = 62,5%.
Phòng Giáo dục và Đào tạo …..
Đề kiểm tra 45 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 5)
Câu 1: Oxi hoá 22,4 gam sắt, thu được 32 gam oxit sắt.
a) Xác định tên và công thức của oxit sắt.
b) Xác định hoá trị của sắt trong oxit này.
Câu 2: Viết phương trình hoá học biểu diễn sự oxi hoá các chất sau:
a) Rượu etylic(C2H5OH)
b) Khí metan (CH4)
c) Khí đất đèn (C2H2)
d) Khí gas (C4H10)
e) Khí ammoniac (NH3) tạo thành NO và H2O
f) Khí hidro (H2)
Sản phẩm cháy của các hợp chất: C2H6O; C2H2; CH4; C4H8 đều tạo thành CO2 và H2O.
Câu 3: Đốt cháy hoàn toàn 3,7 gam hỗn hợp khí Z gồm metan và butan (C4H10. Sau khi kết thúc phản ứng, thu được 11 gam khí CO2. Tính thành phần phần trăm theo khối lượng mỗi khí trong hỗn hợp ban đầu.
Đáp án và hướng dẫn giải
Câu 1: a) Ta có: nFe = 22,4/56 = 0,4 (mol)
2xFe + yO2 −to→ 2FexOy (1)
(mol) 0,4 → 0,4/x
Theo đề bài, ta có phương trình :

Chọn x = 2, y = 3 → Công thức oxit sắt: Fe2O3.
b) Gọi hoá trị của sắt trong Fe2O3 là a. Ta có:
2 × a = 3 × II → a = III.
Vậy hóa trị của sắt trong Fe2O3 là III.
Câu 2 :
C2H6O + 3O2 −to→ 2CO2 + 3H2O
CH4 + 2O2 −to→ CO2 + 2H2O
C2H2 + 5/2 O2 −to→ 2CO2 + H2O
C4H10+ 13/2 O2 −to→ 4CO2 + 5H2O
4NH3 + 5O2−to→ 4NO + 6H2O
2H2 + O2 −to→ 2H2O
Câu 3 : Gọi a là số mol CH4 và b là số mol C4H10.
Ta có : nCO2= 11/44 = 0,25 (mol)
Phản ứng :
CH4 + 2O2 −to→ CO2 + 2H2O (1)
(mol) a → a
C4H10 + 13/2 O2 → 4CO2 + 5H2O (2)
(mol) b → 4b
Theo đề bài, ta có hệ phương trình:
{(mZ=mCH4+ mC4H10 và nCO2= nCO(2/(1))+nCO(2/(2)) ) ⇔ {(16a+58b=3,7 và a+4b=0,25)
Giải hệ phương trình, ta được: a=0,05; b==0,05.
Vậy: % mCH4= 0,05×16/3,7 x 100% = 21,62%
% mC4 H10= 0,05×58/3,7 x 100% = 78,38%

Để lại một phản hồi